Optimiser le suivi des patients hypothyroïdiens grâce à la génomique : une révolution clinique en marche
Introduction
L’hypothyroïdie, touchant environ 5 % de la population adulte, est souvent prise en charge de manière standardisée par une supplémentation en lévothyroxine (LT4). Pourtant, de nombreux patients persistent avec des symptômes malgré une TSH dans les normes. Pourquoi cet écart ? La génomique nous offre aujourd’hui des éléments de réponse et ouvre la voie à une approche beaucoup plus personnalisée du suivi de l’hypothyroïdie.
Apports de la génomique
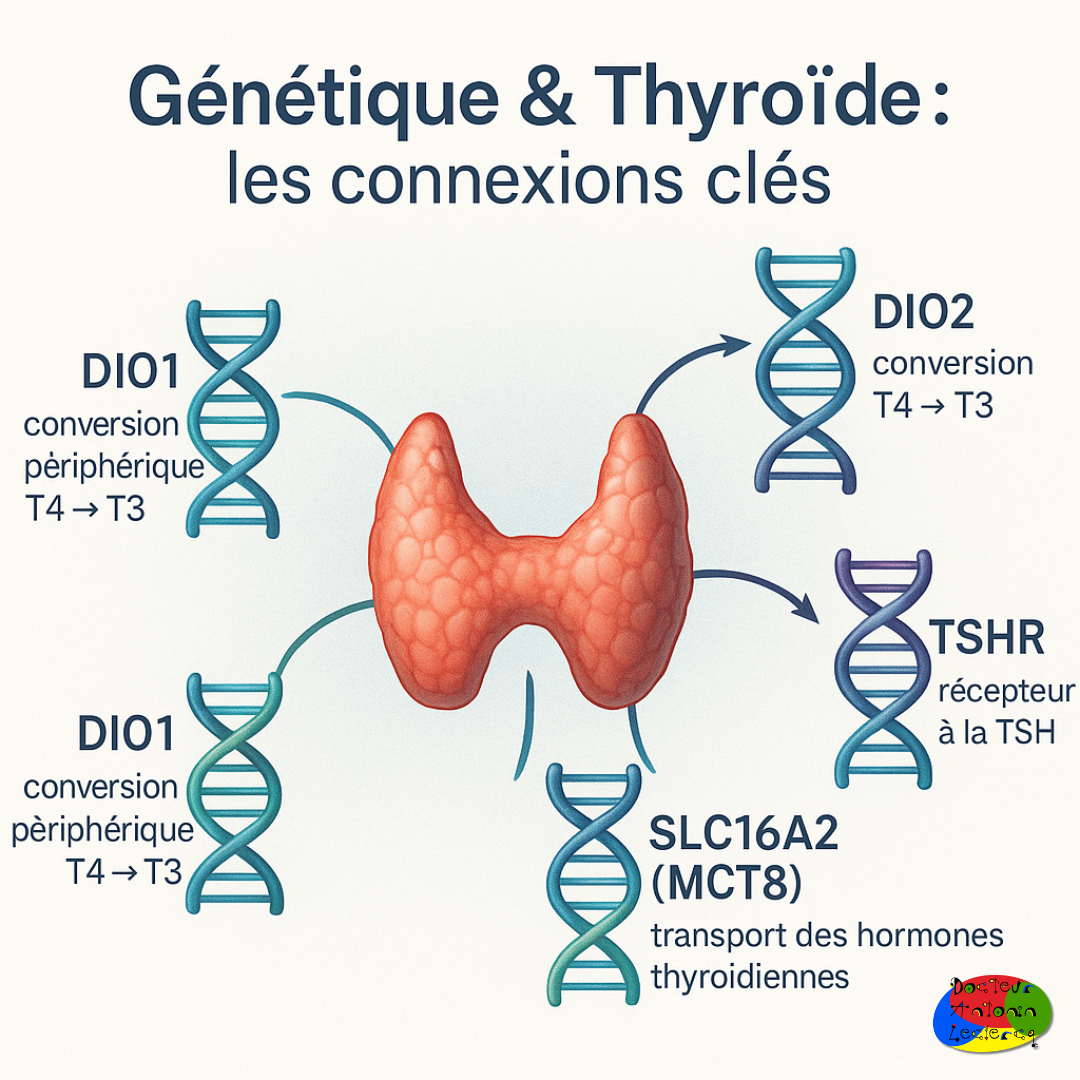
La fonction thyroïdienne est finement régulée par plusieurs gènes intervenant à différentes étapes du métabolisme hormonal :
-
DIO1 et DIO2 : codent pour des déiodinases, enzymes convertissant la T4 (inactive) en T3 (active).
-
SLC16A2 (MCT8) : code pour un transporteur essentiel au passage intracellulaire des hormones thyroïdiennes.
-
TSHR : code pour le récepteur de la TSH au niveau thyroïdien, influençant la sensibilité au signal hormonal.
-
MTHFR et COMT : gènes liés au métabolisme des folates et de la méthylation, processus essentiels pour la sensibilité tissulaire aux hormones thyroïdiennes.
Des polymorphismes sur ces gènes peuvent altérer la conversion hormonale, le transport ou la réponse cellulaire, expliquant une symptomatologie résiduelle malgré un traitement conventionnel.
Tests génétiques disponibles
Des panels génétiques ciblés pour la santé thyroïdienne sont aujourd’hui proposés par plusieurs laboratoires spécialisés en médecine fonctionnelle.
Ils incluent typiquement :
-
Déiodinases (DIO1, DIO2)
-
Transporteurs (SLC16A2)
-
Récepteurs hormonaux (TSHR)
-
Métabolisme méthylique (MTHFR, COMT)
Les méthodes sont basées sur des analyses PCR ou séquençage de nouvelle génération (NGS). Toutefois, il faut rester prudent : tous les polymorphismes ne sont pas encore validés par des études cliniques robustes.
Focus : DIO2, un acteur clé dans l’optimisation du traitement de l’hypothyroïdie
Le gène DIO2 (deiodinase type 2) code pour une enzyme essentielle qui catalyse la conversion de la thyroxine (T4), forme circulante inactive, en triiodothyronine (T3), forme biologiquement active des hormones thyroïdiennes.
Cette conversion intracellulaire est déterminante pour assurer une réponse tissulaire adaptée, indépendamment des taux sériques de T3 et T4.
Pourquoi DIO2 est-il si critique ?
Chez certains patients, notamment porteurs de polymorphismes du gène DIO2, cette conversion peut être ralentie ou altérée. Le plus étudié est le polymorphisme Thr92Ala (rs225014), où une substitution d’acide aminé (thréonine → alanine) est associée à une diminution de l’activité enzymatique de la DIO2 [1].
Résultat : malgré une TSH normalisée sous traitement standard par lévothyroxine seule, ces patients peuvent présenter des symptômes persistants d’hypothyroïdie : fatigue, dépression, ralentissement cognitif [2].
Conséquences cliniques pratiques
-
Traitement combiné LT4/LT3 : Plusieurs études suggèrent que les patients porteurs du polymorphisme Thr92Ala pourraient bénéficier d’une supplémentation directe en T3 (par exemple, en combinant levothyroxine et liothyronine) pour compenser cette altération de conversion [3,4].
-
Optimisation du choix galénique : Chez ces patients, l’utilisation de formulations galéniques lentes ou à libération prolongée de T3 est également une piste pour éviter les pics plasmatiques et mieux mimer la sécrétion physiologique [5].
-
Approches complémentaires : Un soutien nutritionnel par le sélénium (cofacteur des déiodinases) pourrait également être envisagé pour optimiser l’activité enzymatique restante [6].
Données génétiques disponibles
Les tests génétiques ciblant le polymorphisme DIO2 Thr92Ala sont aujourd’hui intégrés dans plusieurs panels de médecine personnalisée, permettant d’identifier précocement les patients pour lesquels un traitement standard pourrait être insuffisant.
Implications pour le suivi personnalisé
L’intégration des données génétiques permet plusieurs ajustements cliniques :
-
Formulation du traitement : un patient DIO2 muté pourrait bénéficier d’un traitement combiné LT4/LT3 plutôt que de LT4 seul.
-
Forme galénique : privilégier des formes liquides ou micro-dosées si des anomalies de transport (MCT8) sont identifiées.
-
Supplémentation ciblée :
-
Sélénium pour soutenir les déiodinases (surtout DIO2).
-
Zinc et vitamines B9/B12 pour optimiser la méthylation si mutation MTHFR.
-
-
Approche anti-oxydante : renforcer la défense cellulaire si des marqueurs de stress oxydatif sont associés à une dysfonction thyroïdienne.
Limites et perspectives
Malgré ses promesses, la génomique dans l’hypothyroïdie reste un domaine jeune :
-
Peu de guidelines officielles existent pour intégrer systématiquement les résultats dans l’algorithme thérapeutique.
-
Le coût des tests peut limiter l’accessibilité pour certains patients.
-
Une interprétation génétique isolée sans évaluation clinique globale reste risquée.
Néanmoins, l’évolution rapide de la recherche et la démocratisation des tests laissent entrevoir une intégration beaucoup plus fluide dans le futur suivi médical.
Conclusion
La génomique ne remplace pas l’examen clinique, mais elle en devient un allié de poids pour personnaliser le suivi des patients hypothyroïdiens.
Pour les professionnels de santé, c’est une opportunité : celle d’ouvrir de nouvelles pistes d’investigation quand le traitement standard atteint ses limites.
À retenir : penser au-delà de la TSH, explorer la génétique, et ajuster le suivi en fonction du patient… et non de la moyenne statistique.
Références bibliographiques
-
Peeters RP, van der Deure WM, Visser TJ. Genetic variation in thyroid hormone pathway genes: polymorphisms in deiodinases. Eur J Endocrinol. 2006;155(5):655-662. doi:10.1530/eje.1.02268
-
Panicker V, Cluett C, Shields B, Murray A, Parnell KS, Perry JR, et al. Common variation in the DIO2 gene predicts baseline psychological well-being and response to combination thyroxine plus triiodothyronine therapy in hypothyroid patients. J Clin Endocrinol Metab. 2009;94(5):1623-1629. doi:10.1210/jc.2008-1301
-
Appelhof BC, Peeters RP, Wiersinga WM, et al. Polymorphisms in type 2 deiodinase are not associated with well-being, neurocognitive functioning, and preference for combined thyroxine/T3 therapy. J Clin Endocrinol Metab. 2005;90(9):5566-5571. doi:10.1210/jc.2005-0532
-
Wiersinga WM. Paradigm shifts in thyroid hormone replacement therapies for hypothyroidism. Nat Rev Endocrinol. 2014;10(3):164-174. doi:10.1038/nrendo.2013.258
-
Celi FS, Zemskova M, Linderman JD, et al. Metabolic impact of combined triiodothyronine/thyroxine therapy: a randomized controlled trial. Thyroid. 2011;21(12):1313-1320. doi:10.1089/thy.2011.0190
-
Köhrle J. Selenium and the thyroid. Curr Opin Endocrinol Diabetes Obes. 2015;22(5):392-401. doi:10.1097/MED.0000000000000183